TRICOMONIASIS
Por: Doctor Walter Urteaga Pasache
Tratamiento de la pareja: En la práctica médica ginecológica, el mayor porcentaje de consultas es consecuencia de sintomatología vaginal, y de ellas, la más frecuentes son las infecciones vaginales mixtas, donde la Trichomonas vaginalis, tiene una participación cada vez más importante. En tal sentido se presenta la siguiente revisión sobre esta patología en la mujer y el hombre.
Generalidades
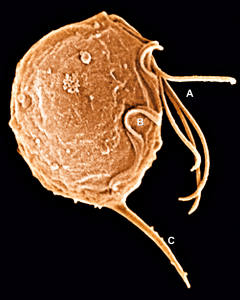
La Trichomona vaginalis o Tricomona vaginalis fue descubierta por Alfred Francois Donné en 1835, confirmado posteriormente en 1855 por Alfred Koelliker y Fiedrich Wilhem von Scanzoni, pertenece al reino protista excavata filo metamonada, clase parabasalia, orden Trichomonadida, género Trichomonas y especie T. Vaginalis. Es patógeno humano y uno de los más de cien especies de tricomonas existentes.
Es un protozoario flagelado siendo un trofozoíto piriforme con 10-30 micras de longitud y 10-18 micras de ancho en promedio; cuenta con un solo núcleo oval excéntrico careciendo de mitocondrias, su única forma morfológica de vida es ésa (trofozoíto) porque no forma quistes, aunque sobrevive en un pH ambiental ácido entre 5.5 a 5.8. Sin embargo, puede resistir condiciones climáticas muy severas entre los 0 °C a más de 40 °C.
Es monexeno, quiere decir que su ciclo de vida es directo porque sólo necesita a un solo huésped u hospedador para su desarrollo y madurez. Tiene cuatro flagelos en su parte delantera y uno en la parte trasera haciendo el total de cinco flagelos, cuyas funciones son conferirle movimientos rápidos de traslación y rotación característicos.
Los cuatro flagelos anteriores nacen en el blefaroplasto, encima del núcleo, y recorren el canal periflagelar, que está rodeado por la pelta, una red de microtúbulos que recubre parcialmente las estructuras basales de los cuatro flagelos.
El quinto flagelo está formado por un citoesqueleto de actina y tubulina y proporciona un movimiento ondulante. Este flagelo está situado en la parte posterior formando la membrana ondulante, asociadaa una estructura llamada costa, cuya función es dar resistencia a la estructura del parásito. Se multiplica en forma asexuada por fisión binaria longitudinal, posee un grueso axostilo (son una serie de microtúbulos que se encuentran en varias clases de protozoos).
El núcleo es grande, ovalado, excéntrico y localizado hacia el extremo anterior. La infección producida por este protozoo flagelado se denomina tricomoniasis vaginal. El hombre es el único huésped natural conocido; siendo el varón el vector y la mujer quien es afectada. El vector transporta el parásito, muchas veces sin sintomatología alguna, pero lleva la infección.
En la mujer se establece el parásito y como nuevo huésped permite su desarrollo y acción patógena.
La infección tiene como mecanismo de transmisión principal el contacto sexual. La infección durante el baño o con fómites es altamente improbable, en forma ocasional puede ser contraída a través de piscinas, aguas termales y por el uso compartido de ropa interior, toallas, y otros. Esta forma de transmisión no venérea –por fómites– se ha comprobado en niñas y mujeres vírgenes. El parásito se reproduce en las vías urinarias y genitales.
Epidemiología
La infección por Trichomona vaginalis afecta la vagina, uretra y cuello en mujeres y uretra en el varón, siendo en su gran mayoría sintomático en las mujeres, mientras que en el varón –como vector– cursa generalmente asintomática. Es una de las infecciones de transmisión sexual más referidas y conocidas en el ámbito mundial, se cree que es una de las más comunes y frecuentes. En algunas regiones del Mundo existe una alta incidencia y prevalencia de hasta 180 millones de casos nuevos al año.
Generalmente se presentan en mujeres en edad fértil, con un pico entre los 16-35 años, grupo etario en el cual se calcula que entre 10%-30% están infectadas. En EE.UU. se calcula que ocurren aproximadamente 16 millones de infecciones nuevas anualmente. En México la “Información Epidemiológica de Morbilidad Anuario 2011 – Versión Ejecutiva 2011”, emitida por la Secretaría de Salud y la Dirección
General de Epidemiología en el 2012, la tricomoniasis urogenital ocupó el duodécimo lugar entre las “Veinte principales causas de enfermedades transmisibles”, con 113,843 casos notificados, equivalentes a 104.23 casos/100,000 habitantes. Las mujeres fueron más afectadas que los hombres en una proporción de 36:1, y el grupo de edad con mayor número de casos correspondió al de 25-44 años.
Fisiopatología
T. vaginalis es un protozoo flagelado, al adherirse a las células epiteliales vaginales toma forma ameboide con proyecciones citoplasmáticas digitiformesque interactúan con las células dianas. El período de incubación de la infección por T. vaginalis es de 4 a 28 días. Durante esta etapa las bacterias de Doderlein (en su mayoría Lactobacillus acidophilus) se conservan y hay poca o ninguna reacción inflamatoria.
En varios estudios de los métodos anticonceptivos, como el anillo vaginal, se ha observado que al aumentar la cantidad de Lactobacillus acidophilus este actúa como un factor protector contra la infección por el protozoo. A medida que la infección avanza estos parámetros se invierten, es decir, paulatinamente desaparecen los lactobacilos y se reemplaza por una flora bacteriana mixta, con un aumento del número de leucocitos y de parásitos. Durante la excitación y el acto sexual, la mujer secreta fluidos que aumentan el pH vaginal, normalmente ácido (3.5-4.8); además el semen que es alcalino, facilita la transmisión del parásito, porque el pH alcalino es ideal para que el T. vaginalis se desarrolle y produzca la infección. Los mecanismos de patogenicidad del T. vaginalis son de dos clases: los dependientes y los independientes del contacto.
A) Mecanismos dependientes del contacto: unión entre el parásito y la célula epitelial. La adherencia del parásito a la célula está mediada por las proteínas de unión presentes en T. vaginalis: AP120, AP65 (esta proteína genera la respuesta inmune porque está presente en gran parte de la membrana del protozoo), AP51, AP33 y AP23. Tras la adherencia, la T. vaginalis adopta una forma ameboide que aumenta su contacto con la célula. Para que la adherencia sea eficaz, es necesaria la presencia de cisteína-proteinasas ubicadas en la superficie del parásito. Se conocen 11 de estas enzimas que intervienen en el proceso y una de ellas está involucrada en la apoptosis de la célula epitelial.
El parásito finalmente se une a la laminina y la fibronectina del epitelio vaginal. Además, la T. vaginalis está recubierta por lipofosfoglucano (LPG), molécula muy importante para su adherencia a la célula epitelial.
Para su nutrición, la T. vaginalis aprovecha al glóbulo rojo, utilizando el colesterol de su membrana y el hierro de la hemoglobina que transporta. Para ello tiene en la superficie dos carbohidratos importantes en la adherencia a los eritrocitos y la lisis de los mismos: D-lactosa y N-acetil-b-D-glucosamina.
B) Mecanismos independientes del contacto: intervienen en el factor de desprendimiento celular (CDF, por su sigla en inglés), los desechos del parásito y la merma de la concentración de estradiol en la vagina. Cuando el CDF interactúa con la célula epitelial, induce su desprendimiento. Se acepta que el CDF es un marcador de virulencia porque al elevarse su concentración aumenta la sintomatología.
Durante la menstruación el déficit de estrógenos aumenta la concentración de CDF y da lugar a una sintomatología más fuerte. La T. vaginalis afecta más a las mujeres debido a cambios hormonales ya que durante la menstruación el parásito aprovecha el hierro existente en el flujo sanguíneo que le permite aumentar su capacidad de adherencia a tejidos.
En los periodos en que no hay menstruación las concentraciones de hierro son reducidas, lo que provoca que el protozoario tenga movilidad y busque alimentarse. Esto sugiere que el patógeno se adapta a las condiciones ambientales cambiantes de la vagina y permanece en ella.
Respecto a lo que sucede en el hombre infectado, las concentraciones de zinc contenidas en su semen tienen capacidad trichomonicida que destruye al protozoario. En varones con niveles bajos de zinc, el parásito vive en estado latente convirtiendo a los varones en portadores y vectores de la enfermedad.
A su vez, las mujeres embarazadas y enfermas de tricomoniasis tienen un embarazo de alto riesgo, con partos prematuros y fetos que nacen con bajo peso. Esta enfermedad no produce secuelas, como en el caso de la sífilis, que puede causar ceguera al producto de la concepción. Sin embargo, el recién nacido de bajo peso tiene el riesgo de tener repercusiones en su desarrollo al ser más susceptible a otros padecimientos más fuertes.
Ciclo de vida
El transporte del parásito se realiza entre las mucosas durante el acto sexual y se efectúa mediante las secreciones de quienes participan en él, como el flujo vaginal, el líquido preseminal y el semen.
Una vez que el parásito invade la mucosa genital, tiene preferencia por localizarse en el caso de la mujer, en las glándulas de Bartholino y glándulas parauretrales y en sus secreciones, además de la vagina y el cuello uterino. En el hombre se coloniza principalmente el surco balano-prepucial, las glándulas prepuciales, la uretra prostática y las vesículas seminales.
Una vez que el trofozoíto se encuentra en la mucosa –y como ya se mencionó– se reproduce mediante fisión binaria longitudinal y crece con la presencia de sales de hierro como la que encuentra en la sangre menstrual y de la glucosa, presente en el epitelio vaginal durante la edad fértil. Además, lo favorece el pH alcalino que se produce tras colonizar el epitelio sano. El parásito puede sobrevivir en la orina durante unas tres horas y en el semen durante otras seis horas.
Incluso, se han encontrado parásitos vivos y con capacidad de infectar en inodoros, piscinas y zonas húmedas, tras 24 horas a 35 ºC. En ambientes secos, calurosos y en la luz solar directa, el parásito muere aproximadamente a los 30 minutos.
Sintomatología
Las mujeres son más propensas que los hombres a presentar sintomatología por infección a la T. vaginalis.
La infección es más probable cuando se eleva fisiológicamente el pH vaginal y, por ende, el número de parásitos durante la menstruación, la ovulación o el período poscoital. En estas situaciones la sintomatología se acentúa.
En las infecciones por T. vaginalis se puede observar leucorrea abundante, espumosa, con olor fuerte o fétida y de color amarillo verdoso. Las mujeres infectadas refieren prurito vulvar y/o en el interior de los muslos, hinchazón de los labios, dispareunia y disuria, que se intensifican durante la menstruación.
A la especuloscopia, se observa eritema vaginal y cervical que muchos autores denominan “vagina en empedrado” y “cérvix en fresa”, esta signología se presenta causada por la dilatación de los capilares y las hemorragias puntiformes. Durante la infección el pH vaginal puede aumentar hasta 5,0. La tricomoniasis como enfermedad de transmisión sexual puede estar asociada a adenitis inguinal, piosalpingitis, endometritis, uretritis, vaginitis, cervicitis, enfermedad inflamatoria pélvica (EPI) e infertilidad tubárica; por lo tanto si diagnosticamos la presencia de una tricomoniasis, debemos descartar otras infecciones de transmisión sexual (ITS). En las mujeres embarazadas, predispone a la ruptura prematurade membranas (debido a la inducción de citocinas proinflamatorias producidas por el sistema inmune al atacar a la T. vaginalis), lo que lleva a entrar en trabajo de parto pretérmino con la consecuencia de un feto de bajo peso al nacer. Durante el parto, las mujeres infectadas pueden transmitir el parásito verticalmente al recién nacido,produciéndole una infección genitourinaria o una neumonía neonatal. En individuos que practican el sexo oral ha habido informes del parásito en las vías respiratorias bajas, produciendo neumonía.
Los varones tienden a sufrir una infección asintomática y actúan como vectores o reservorios de T. vaginalis. Sin embargo, cuando la infección se hace evidente por la mayor proliferación del parásito, puede manifestarse con secreción uretral serosa o purulenta, prurito en el glande, edema prepucial, erección dolorosa, ardor al eyacular, eyaculación precoz y disuria.
En cuanto a las complicaciones incluyen: uretritis, balanopostitis, prostatitis, cistitis, epididimitis y esterilidad; esta última se produce al unirse T. vaginalis a la cola y la cabeza del espermatozoide, limitando su motilidad y retrasando su desplazamiento. En la actualidad existe una controversia respecto a la relación entre la tricomoniasis en varones y la predisposición a padecer cáncer de próstata. Estudios recientes defienden tanto la posición afirmativa como la contraria, de modo que aún no hay consenso al respecto.
Los trabajadores de la salud deben ceñirse estrictamente a las normas de higiene durante el control cotidiano de los pacientes o durante el examen ginecológico vaginal, puesto que en caso contrario pueden originar infecciones nosocomiales.
Metodología diagnóstica
La T. vaginalis es una de las ITS más extendida sen el mundo, no obstante aún no existe un método aceptable para el diagnóstico de laboratorio útil para todas las circunstancias, de bajo costo, rápido, sencillo y con valores de predictibilidad, tanto negativos como positivos. Sin embargo, se presentan los siguientes; en el caso de la mujer, la muestra de elección para la búsqueda del parásito es el fluido vaginal, mientras que en el hombre es el semen por su mayor sensibilidad, aunque los métodos diagnósticos para este grupo son más limitados.
El método más común es la especuloscopia observando la secreción y buscando la presencia de espuma, características de cuello uterino, paredes vaginales y el estudio directo en fresco buscando los protozoarios, pero éste último es muy incierto con muchos falsos negativos.
El método más apropiado, debido a su sensibilidad (98%) y especificidad (100%), es el cultivo en los caldos de Roiron y de Diamond. En ellos, para evitar el crecimiento de otros microorganismos se añaden al caldo antibióticos y fungicidas. Es un proceso de bajo costo y sólo es necesario un inóculo de 300 a 500 tricomonas/mL.
El mayor inconveniente es el tiempo de incubación, que oscila entre dos y siete días.
Otro dispositivo para cultivar T. vaginalis, con sensibilidad del 87% y especificidad del 100%, es el InPouch TV, que ofrece ventajas como su facilidad de manejo y su capacidad de inhibir el crecimiento de levaduras, mohos, bacterias y otros microorganismos comensales; este método es más eficaz que el examen microscópico directo.
El rendimiento de esta prueba depende del entrenamiento de la persona encargada de hacerla, y se debe realizar idealmente en las primeras dos horas de obtenida la muestra, pues T. vaginalis pierde movilidad con el correr del tiempo, dificultando así su reconocimiento. También es útil la tinción de Papanicolaou, pero tiene baja sensibilidad. La reacción en cadena de polimerasa (PCR) ha dado resultados satisfactorios en secreción vaginal y orina, con alta sensibilidad y especificidad, pero es un método con limitaciones debido a su alto costo. Las técnicas inmunológicas clásicas de EIA (enzimoinmunoanálisis) e IFD (inmunofluorescencia directa) tienen menor sensibilidad que el cultivo o que las técnicas moleculares como la PCR, por lo que son poco usadas, pero son una opción más para el diagnóstico de la infección.
La prueba de ELISA (ensayo por inmunoabsorción ligado a enzimas) basada en la búsqueda de IgA, IgM e IgG específicas para tricomonas no ha sido eficaz. En un estudio comparativo de hombres sanos con otros infectados por el parásito, se observó que en los casos sintomáticos hubo una elevación significativa en los niveles de IgM e IgG en muestras uretrales en comparación con los individuos sanos. Las inmunoglobulinas aumentan o disminuyen según la intensidad de la sintomatología.
Tratamiento
El tratamiento actual debe ser imperativamente dirigido a la pareja, aunque el varón sea asintomático constituye un vector o reservorio; si no se prescribe el tratamiento a la pareja o a los individuos involucrados con ella, se corre el riesgo de perpetuar la reinfección y la prevalencia de la enfermedad. El tratamiento se basa en los fármacos de la familiade los nitroimidazoles, que se dividen en dos grupos:los 2-nitroimidazoles, que incluyen el misonidazol y el benzonidazol, y los 5-nitroimidazoles, que incluyen: metronidazol, tinidazol, ornidazol, secnidazol, carnidazol, nimorazol y satranidazol.
- Metronidazol
El metronidazol, penetra la pared de T. vaginalis y se reduce por las enzimas ferredoxina-oxidorreductasa y flavodoxina, produciendo dos compuestos tóxicos llamados N-2-hidroxietil del ácido oxámico y acetamida,que rompen las uniones de timina y adenina del ADN, destruyéndolo. El metronidazol tiene un alto volumen de distribucióny poca afinidad por las proteínas. Se metaboliza en el hígado mediante el citocromo P450 (CYP450). Su excreción es, en orden descendente, renal (77%), fecal (14%) y pulmonar (5%). El 4% restante se excreta en la leche materna, el semen, el fluido vaginal, la saliva y la bilis. La dosis actual para el tratamiento de la tricomoniasis es de 500 mg cada 12 horas por 7 días, además en caso de las mujeres se mejora la efectividad del tratamiento mediante óvulos vaginales de tinidazol o metronidazol.
Los efectos adversos son muy frecuentes e incluyen cefalea, náuseas, sequedad de la boca, sabormetálico y lengua pastosa, vómito, diarrea y dolor abdominal, glositis y estomatitis, mareos, vértigo, disuria, cistitis y sensación de presión en la pelvis. Es muy importante recordarle al paciente que no tome alcohol desde el comienzo del tratamiento hasta después de 48 horas de haberlo finalizarlo, porque se puede presentar el efecto antabuse que produce vasodilatación brusca con enrojecimiento facial intenso, palpitaciones, sudoración, visión borrosa, náuseas, taquicardia, dificultad respiratoria y debilidad generalizada.
Desde la introducción del metronidazol como agente antiparasitario en 1957 contra T. vaginalis ha mantenido una buena actividad in vitro contra este parásito durante años; sin embargo, la aparición lenta pero progresiva de resistencias ha despertado un renovado interés en nuevos fármacos que mantengan la actividad contra T. vaginalis, como es el caso del tinidazol. Las mutaciones en la ferredoxina se han implicado como mecanismos de resistencia contra el metronidazol, pero deben investigarse otros mecanismos posibles de resistencia.
Cabe señalar que estudios recientes realizados en Oxford por Sobel et al, demuestran un 21% de tricomoniasis resistentes al metronidazol versus un 5% resistentes al tinidazol. Además existía 45% de efectos colaterales con metronidazol versus 30% con tinidazol.
Por tanto el tinidazolen dosis única de 2gpor vía oral constituyeuna excelente alternativa terapéutica para la T. vaginalis.
2. Tinidazol
La dosis de tinidazol es de 2 g en dosis única pudiéndose acompañar de óvulos de uso tópico; lo cual resulta una ventaja frente a los 7 días del Metronidazol.
El tinidazol es un agente antiparasitario derivado estructuralmente del metronidazol y con el que comparte el anillo 5-nitroimidazólico básico. En mayo del 2004, la FDA aprobó su uso entre otras patologías, para el tratamiento de la T. vaginalis y Gardenella vaginalis . El tinidazol por vía oral es reducido intracelularmente en su grupo nitro por radicales tóxicos de baja vida media producidos por un sistema de transporte de electrones que implica ferredoxina. Se generan así nuevas moléculas con actividad biológica. Este sistema crea un gradiente positivo para la entrada de nuevas moléculas de tinidazol dentro de la célula según se destruyen las que previamente habían entrado. Estudios sugieren que el principal mecanismo de acción es que estos intermediarios tóxicos se unen al ADN bacteriano mediante enlaces covalentes, rompiendo su estructura de doble hélice. Los sistemas enzimáticos que activan al tinidazol sólo están activos en bacterias y parásitos anaerobios, lo que explica la afinidad de este fármaco frente a anaerobios como la T. vaginalis. En células de mamíferos o en bacterias aerobias la presencia de oxígeno y el alto potencial de oxidación-reducción inhiben el proceso de reducción.
Por último Pépin J, Sobela F, Khonde N, Agyarko- Poku T, Soumaila D, Deslandes S, et al. publicaron un estudio en 1570 mujeres tratadas con la combinación de tinidazol más fluconazol (dosis única de 2 g de tinidazol más 150 mg de fluconazol) en comparación con administración de 7 días de metronidazol más tres días de tratamiento con clotrimazol tópico; con resultados similares en ambos grupos. Tasas de respuesta de 67% frente a 64% respectivamente, con la ventaja de la dosis única del tinidazol que evita el abandono de tratamiento y minimiza los efectos colaterales del metronidazol.
Metronidazol vs. Tinidazol
Hay numerosos estudios que exploran la actividad in vitro del tinidazol tanto frente a protozoos anaerobios como frente a bacterias anaerobias. Con respecto a los primeros, la concentración mínima letal (CML) de tinidazol frente a T. vaginalis sensible al metronidazol (CML <50 μg/ml) es mucho menor (≤2,35 μg/ml).
En líneas generales, la actividad in vitro de tinidazol en comparación con metronidazol es un 1,8 veces mayor, lo que se puede traducir en que en el 60% de los aislamientos la actividad in vitro de tinidazol es mayor que la de metronidazol, mientras que sólo en el 2% de los aislamientos, metronidazol presenta mayor actividad que tinidazol. (CML>50 μg/ml), aproximadamente el 25% de estos aislamientos fueron sensibles a tinidazol. En un estudio con 178 aislamientos de T. vaginalis 17 fueron resistentes a metronidazol (9,6%) mientras que la resistencia a tinidazol fue sólo del 0,56% (1 cepa).
Aunque el tinidazol tiene la aprobación de la FDA desde 2004 para el tratamiento de Giardia intestinalis, Trichomona vaginalis y Gardenella vaginalis, entre otros patógenos, se viene empleando desde hace más de 20 años con una elevada eficacia (>90%) en infecciones por anaerobios.
En comparación con el metronidazol, el tinidazol ofrece una vida media más larga, concentraciones plasmáticas mayores, y mayor actividad in vitro frente a bacterias y parásitos anaerobios. Esto posibilita, por una parte, la administración del tinidazol una vez al día lo que facilita el cumplimiento del tratamiento, y por otra parte, ofrece un mejor perfil farmacodinámico que el metronidazol. Además brinda una importante reducción de acontecimientos adversos, en comparación con el metronidazol. Otro aspecto importante del tinidazol es que puede resultar efectivo tras fracasos terapéuticos con metronidazol.
Cortesía de:
FUENTES
-Atias-Neghme. Parasitología Clínica. 3ra. Ed. Publicaciones Técnicas. Santiago de Chile: Mediterráneo Ltda. 1994:365-73.
-Markell, E.K., Voge, M., y John D.T. Parasitología médica. Interamericana. McGraw-Hill. Madrid.1990.
-Soulsby, E.J.L.Parasitología y enfermedades parasitarias en los animales domésticos. Interamericana. México. 1987.
-Ospina Diaz JM, Ariza Riaño NE. Tema de revision: Trichomonas Vaginalis. Rev. Salud. Hist. Sanid. 2008;3(3):1-33.
-Cabello R. Microbiología y parasitología humana. 3ra Edc. México, D.F.: Panamericana; 2007.
-Hernández Álvarez H, Sariego Ramos I, Sarracent, Pérez J. Infección humana por Trichomonas vaginalis y su relación con otros agentes patógenos. Rev Cuba ObsGinecol. 2009;35(4):108-17.
-Sutcliffe S, Neace C, Magnuson NS, Reeves R, Alderete JF. Trichomonosis, a common curable STI, and prostate carcinogenesis-a proposed molecular mechanism. PLoS Pathog. 2012 Jan;8(8):e1002801.
-Tamayo Acevedo LS, Guevara Romero E, López Martínez MI.Vaginosis bacteriana, candidiasis y tricomoniasis por citología
cérvico-vaginal en mujeres del régimen subsidiado, Medellín-Colombia, 2008. Rev Salud Pública Medellín. 2010;4(2):87-100.
-Salas N, Ramírez J, Ruiz B, Torres E, Jaramillo L, Gómez J. Prevalencia de microorganismos asociados a infecciones vaginales en 230 mujeres gestantes y no gestantes sintomáticas del centro de salud La Milagrosa en el municipio de Armenia. Rev Colomb Obs Ginecol. 2009;60(2):135-42.
-López N, Gamboa E, Vera L, Castro M, Camacho L. Infecciones vaginales: condición relevante en un centro de reclusión. Prim. Congr. Nac. Investig. en Salud Pública, Oct. 23, 24 y 25 2006. Bogotá D.C.: Pontificia Universidad Javeriana; 2006.
-Ángel-Müller E, Rodríguez A, Núñez-Forero LM, Moyano LF, González P, Osorio E. Prevalencia y factores asociados a la infección Por C. trachomatis, N. gonorrheae, T. vaginalis, C. albicans, sífilis, VIH y vaginosis bacteriana en mujeres con síntomas de infección vaginal en tres sitios de atención de Bogotá, Colombia, 2010. Rev Colomb Obs Ginecol. 2012;63(1):14-24.
-Alejandro Siu-Au, Jorge Calderón-Ticona, Alfredo Guillén-Oneeglio, Arnaldo Silva-Olivera. “Flora Microbiana en las infecciones vaginales y comparación del tratamiento entre dos combinacionesde fármacos”. Publicado en la Revista de la Sociedad Peruana de Medicina Interna”. Enero – Marzo 2011. Vol 24 Nº1. pp:5-11.
-Shethwala ND, Mulla SA, Kosambiya JK, Desai VK. Sexually transmitted infections and reproductive tract infections in female sex workers. Indian J PatholMicrobiol. 2009;52(2):198-9. 12.
-Storti-Filho A, Souza PC, Chassot F, Pereira MW, Souza RJ, Mello IC, Svidizinski TI, Consolaro ME. Association of public versus private health care utilization and prevalence Paraná, Brazil. ArchGynecolObstet. 2009; 280:593-597.
-Hilda María Hernández Alvarez I ; Idalia Sariego Ramos II; Jorge Sarracent Pérez III. Revista Cubana de Obstetricia y Ginecologia.2009;35(4):108 -117.
-Benchimol M. Trichomonads under Microscopy. MicroscMicroanal. 2004;10:528-0.
-Beaver P, Jung RC, Cupp WC. Parasitología clínica. 2da. ed. 1986; España: Salvat.
-Larcen B. Vaginal flora in health and disease. ClinObstet Gynecol. 1993;36:107-21.
-Spiegel CA. Microflora associated with Trichomonas vaginalis and vaccination against vaginal trichomoniasis. En: Honigberg BM, ed. Trichomonads parasitic in human. New York: Springer-Verlag; 1990:213-24.
-Krieger JN, WolnerHanssen P, Steves C, Holmes KK. Characteristic of Trichomonas vaginalis isolates from women with andwithout colpitismacularis. J Infect Dis.1990;161:307-11.
-Wendel KA. Trichomoniasis: What’s new? Curr Infect Dis Rep. 2003;5:12934.
-Botero D, Restrepo M. Parasitosis tisulares por trematodos. En: Botero D, editor. Parasitosis humana. 4ta ed. Medellín: CIB; 2003. p. 294-7.
-Hitti J, Nugent R, Boutain D, Gardella C, Hillier SL, Eschenbach DA. Racial disparity in risk of preterm birth associated with lower genital tract infection. Pediatr Perinat Epidemiol. 2007;21:330-7.
-López-Olmos J, Gasull J. Infección vaginal por tricomonas (e infecciones mixtas) y atipias celulares, en la citología cervicovaginal. Clin Invest Gin Obs. 2011 Jul;38(4):120-7.
-Nogal Ruiz JJ. Modelo experimental de trichomona vaginalis:estudios de quimiosensibilidad, patogenia e inmunomodulación. Universidad Complutense de Madrid; 1999.
-Cadena V. D, Miranda N, Calderón N. Tricomoniasis urogenital. Rev Paceña Med Fam. 2006;3(4):84-9.
-Lin MC, Hui CF, Chen JY, Wu JL. The antimicrobial peptide, shrimp antilipopolysaccharide factor (SALF), inhibits proinflammatory cytokine expressions through the MAPK and NF-kappaB pathways in Trichomonas vaginalis adherent to HeLa cells. Peptides. 2012;38(2):197-207.
-Schwebke JR, Burgess D. Trichomoniasis. ClinMicrobiol Rev. 2004 Oct;17(4):794-803, table of contents.
-Coleman JS, Gaydos CA, Witter F. Trichomonas vaginalis vaginitis in obstetrics and gynecology practice: new concepts and controversies. Obstet Gynecol Surv. 2013 Jan;68(1):43-50.
-Trintis J, Epie N, Boss R, Riedel S. Neonatal Trichomonas vaginalis infection: a case report and review of literature. Int J STD AIDS. 2010 Aug;21(8):606-7.
-Temesvári P, Kerekes A, Tege A, Szarka K. Demonstration of Trichomonas vaginalis in tracheal aspirates in infants with early respiratory failure. J Matern Fetal Neonatal Med. 2002 May;11(5):347-9.
-McLaren LC, Davis LE, Healy GR, James CG. Isolation of Trichomonas vaginalis from the respiratory tract of infants with respiratory disease. Pediatrics. 1983 Jun;71(6):888-90.
-Fule SR, Fule RP, Tankhiwale NS. Clinical and laboratory evidence of Trichomonas vaginalis infection among women of reproductive age in rural area. Indian J Med Microbiol. 2012;30(3):314-6.
-Ozdemir E, Kele-temur N, Kaplan M. Trichomonas vaginalis as a rare cause of male factor infertility at a hospital in East Anatolia. Andrología. 2011 Aug;43(4):283-5.
-La Vignera S, Vicari E, Condorelli RA, D’Agata R, Calogero AE. Male accessory gland infection and sperm parameters (review). Int J Androl. 2011 Oct;34(5 Pt 2):e330-47.
-Groom HCT, Warren AY, Neal DE, Bishop KN. No evidence for infection of UK prostate cancer patients with XMRV, BK virus, Trichomonas vaginalis or human papilloma viruses. PLoS One. 2012 Jan;7(3):e34221.
-Peterson K, Drame D. Iatrogenic transmission of Trichomonas vaginalis by a traditional healer. Sex Transm Infect. 2010 Oct;86(5):353-4.
-Aznar J, Blanco M, Lepe J. Diagnóstico microbiológico de las infecciones detransmisión sexual y otras infecciones genitales. In: Cercenado E, Cantón R, editores. Procedimientos en Microbiol. Clínica. 2007.
-Al-Zanbagi NA, Al-Jehani EF. Recent diagnostic study for the flagellate protozoan Trichomonas vaginalis. J Egypt Soc Parasitol. 2007 Aug;37(2):361-70.
-Sood S, Mohanty S, Kapil A, Tolosa J, Mittal S. InPouch TV culture
for detection of Trichomonas vaginalis. Indian J Med Res. 2007 Apr;125(4):567-71.
-Omer EF, El-Naeem HA, Ali MH, Catterall RD, Erwa HH. Evaluation of the laboratory diagnosis of vaginal trichomoniasis in Khartoum. J Trop Med Hyg. 1988 Dec;91(6):292-5.
-Imam NFA, Eassa AHA, Shoeib EYS, Abo-Raia GYS. Antibody isotypes in urethral swabs of symptomatic and asymptomatic men infected with Trichomonas vaginalis. J Egypt Soc Parasitol. 2007 Dec;37(3):977-88.
-Vázquez F, José García M, Pérez F, Palacio V. [Trichomonas vaginalis: treatment and resistance to nitroimidazoles]. Enferm Infecc Microbiol Clin. 2001 Mar;19(3):114-24.
-Bendesky A. Metronidazol: una visión integral. Rev Fac Med UNAM. 2001;44(6):255-9.
-Lucas Huguet ME. Antiinfecciosos embarazo. Biomedicina. 2001;7(1):6-15.
-Brunton L, Chabner B, Knollmamn B. The pharmacological basis of therapeutics. 12th ed. New York: McGraw-Hill; 2010.
-Subramanian C, Sobel JD. A case of high-level metronidazole-resistant trichomoniasis in pregnancy successfully treated. J Low Genit Tract Dis. 2011 Jul;15(3):248-9.
-Lehker MW, Alderete JF. Resolution of six chromosomes of Trichomonas vaginalis and conservation of size and number among isolates. J Parasitol. 1999 Oct;85(5):976-9.
-Fung HB, Doan T. Tinidazole: a Nitroimidazole Antiprotozoal Agent. Clin Ther 2005;27:1859-84.
-Pépin J, Sobela F, Khonde N, Agyarko-Poku T, Soumaila D, Deslandes S, et al. The syndromic management of vaginal discharge using single-dose treatments: a randomized controlled trial in West Africa. Bull World Health Organ 2006;84:729-38.
-Wybo I, Piérard D, Verschraegen I, et al. Third Belgian multicentre survey of antibiotic susceptibility of anaerobic bacteria. J Antimicrob Chemother 2007;59:132-9.
-Rees PH, McGlashan HE, Mwega V. Single dose treatment of vaginal trichomoniasis with tinidazole. East Afr Med J 1974;51:782-5.
-Nord CE. Microbiological properties of tinidazole: spectrum, activity and ecological considerations. J Antimicro Chemother 1982;10(Suppl. A): 35-42.
-Nord CE, Kager L. Tinidazole-microbiology, pharmacology and efficacy in anaerobic infections. Infection 1983;11:54-60.
-Raether W, Hanel H. Nitroheterocyclic drugs with broad spectrum activity. Parasitol Res 2003;90 (Suppl. 1):S19-S39.
-Tasca T, Borges FP, Bonan CD, De Carli GA, Battastini AM, Sarkis
JJ. Effects of metronidazole and tinidazole on NTPDasa 1 and ecto 5´nucleotidase from intact cells of Trichomonas vaginalis. FEM Microbiol Lett 2003;226:379-84.
-Wiwanitkit V. Identification of weak points prone for mutation in ferredoxin of Trichomonas vaginalis. Indian J Med Microbiol 2008;26:158-9.
-Sears SD, O´Hare J. In vitro susceptibility of Trichomonas vaginalis to 50 antimicrobial agents. Antimicrob Agents Chemother 1988;32:144-6.
-Narcisi EM, Secor W. In vitro effect of tinidazole and furazolidone on metronidazole-resistant Trichomonas vaginalis. Antimicrob Agents Chemother 1996;40:1121-5.
-Schweke JR, Barrientes FJ. Prevalence of Trichomonas vaginalis isolates with resistance to metronidazole and tinidazole. Antimicrob Agents Chemother 2006;50:4209-10.
Edición y textos: Pablo Grimberg. Prohibida su reproducción total o parcial.
Enero 2017